▲ 肿瘤细胞表面硬度减低损害T细胞介导的杀伤作用
为了研究了这种物理免疫检查点是否可以通过增强肿瘤细胞硬度来抑制 。 研究人员制备了ACAT1过表达的B16F10癌细胞(ACAT1 OE B16F10) , 其膜胆固醇水平比天然B16F10细胞低70% 。 这种细胞硬度更高 , 对T细胞介导的细胞毒性表现出更高的敏感性 。 体内实验表明Pmel CD8+ T细胞更好地控制了ACAT1 OE B16F10肿瘤细胞的生长 。 携带ACAT1 OE B16F10肿瘤的小鼠也显示了延长的生存期 。
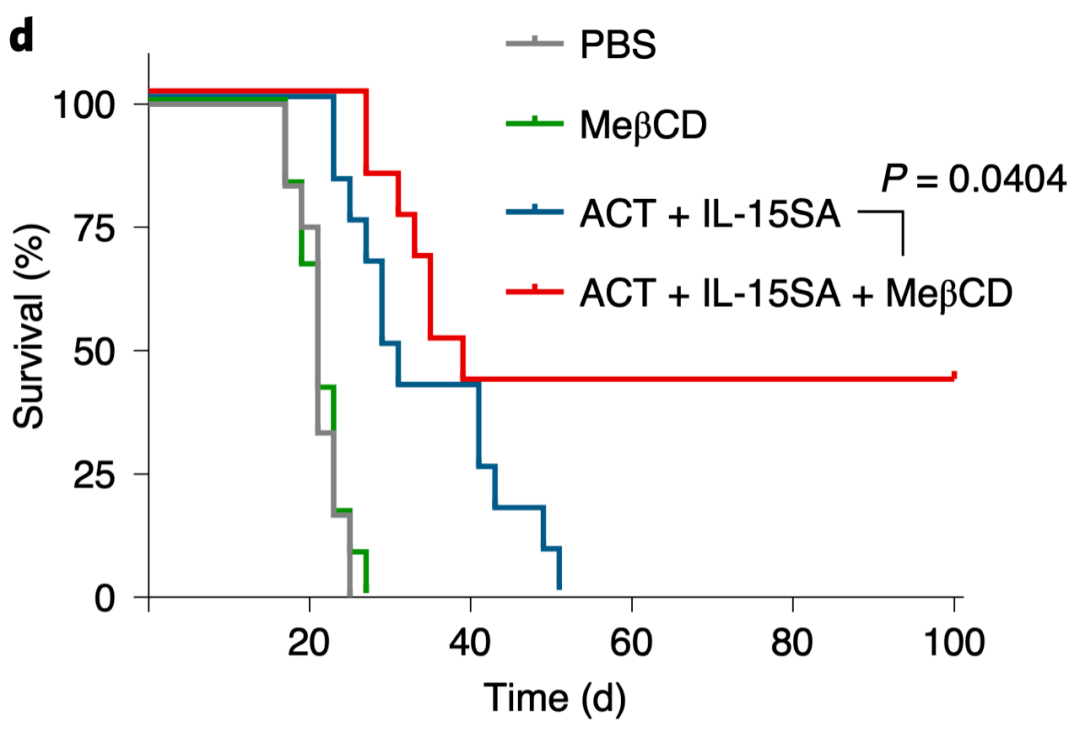
在这些发现的基础上 , 研究人员尝试开发一种可以增加肿瘤细胞硬度的干预方式 , 以增强癌症免疫治疗效果 。 MeβCD处理的B16F10细胞 , 在处理后5小时内可保持较低的膜胆固醇水平 , 且 经MeβCD预处理硬化的肿瘤细胞对T细胞介导杀伤作用的敏感性显著增加 。 在动物实验中发现 , 在不同肿瘤中 ,联合MeβCD干预后 , Pmel CD8+ T细胞过继治疗单用或与IL-15超级激动剂(IL-15SA)联用的治疗效果都得到增强 。
文章图片
▲ MeβCd提高肿瘤细胞硬度 , 增强免疫治疗的疗效
值得注意的是 , MeβCD干预没有引起体重下降、脾肿大、脾脏中CD8+ T细胞浸润和活化增加等副作用 。 MeβCD单独作为一种治疗方法没有治疗效果 , 表明 抗原特异性细胞毒T细胞的存在是杀伤硬度增加的靶细胞的必要条件 。
此外 , 细胞介导的细胞毒性的生化途径 , 如Fas蛋白与Fas配体相互作用 ,IFN-γ和TNF-α等效应细胞因子的分泌 , 以及溶细胞蛋白(如穿孔素和颗粒酶)的颗粒胞吐等 , 未受肿瘤细胞硬化的影响 。
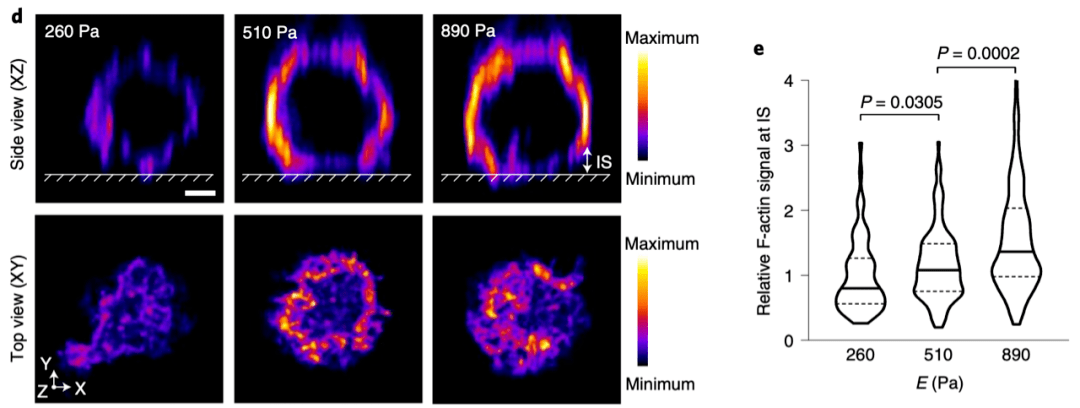
据报道 , 富脯氨酸酪氨酸激酶2(Pyk2)的磷酸化与原代T细胞施加的细胞力呈正相关 。 研究人员通过在不同硬度水凝胶进行实验 , 证明 Pmel CD8+ T细胞在较硬的表面产生更高的机械应力 , 与细胞硬度增强的肿瘤细胞共培养时 , Pmel CD8+ T细胞能诱导更高水平的pPyk2 。 这些结果表明T细胞对硬化的肿瘤细胞施加了更强的细胞力 。
文章图片
▲ T细胞力介导对硬化癌细胞的细胞毒性增强
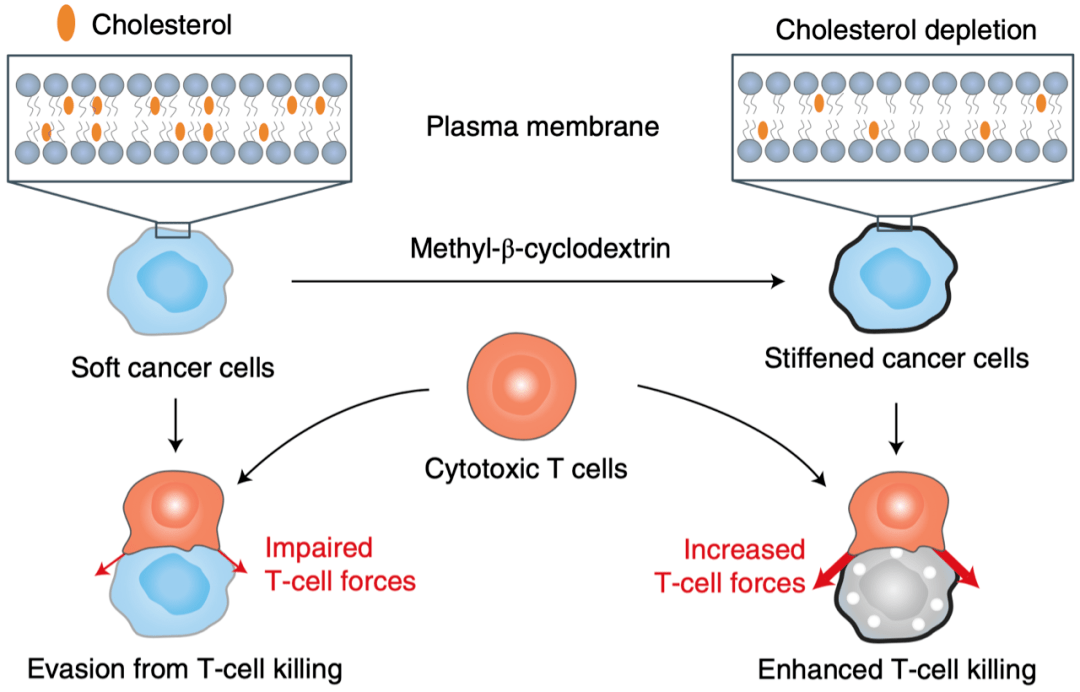
简单来讲 , 本研究发现细胞硬度减低可作为一种物理免疫检查点 。 通过消耗肿瘤细胞质膜胆固醇使癌细胞硬度增加 , 可以抑制这一物理免疫检查点作用 , 增强T细胞介导的杀伤作用 , 提升免疫治疗的效果 。
文章图片
▲ 肿瘤细胞硬度减低引起物理免疫抑制机制图
这一发现加深了我们对肿瘤免疫抑制多维机制的理解 , 为探究新的免疫检查点 , 开发新的肿瘤治疗方法提供了研究思路 。

文章图片
参考文献
[1] Levental KR, Yu H, Kass L, et al. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell. 2009;139(5):891-906. doi:10.1016/j.cell.2009.10.027
[2] Cross SE, Jin YS, Rao J, Gimzewski JK. Nanomechanical analysis of cells from cancer patients. Nat Nanotechnol. 2007;2(12):780-783. doi:10.1038/nnano.2007.388
[6] K?ster DV, Mayor S. Cortical actin and the plasma membrane: inextricably intertwined. Curr Opin Cell Biol. 2016;38:81-89. doi:10.1016/j.ceb.2016.02.021
[7] Basu R, Whitlock BM, Husson J, et al. Cytotoxic T Cells Use Mechanical Force to Potentiate Target Cell Killing. Cell. 2016;165(1):100-110. doi:10.1016/j.cell.2016.01.021
[8] Hui KL, Balagopalan L, Samelson LE, Upadhyaya A. Cytoskeletal forces during signaling activation in Jurkat T-cells. Mol Biol Cell. 2015;26(4):685-695. doi:10.1091/mbc.E14-03-0830
- 免疫|1碗抗癌汤消炎、抗氧化、强免疫!利用大白菜、菇类快速搞定
- 口味|给孩子做个“快手菜” 营养丰富,口味独特,提高身体的免疫力
- 卫生室|《乡村医生诊疗口袋书(先行本)》面世
- 解读|《浙江省医院门诊管理办法》政策解读
- 孩子春节最爱的“香蠕菜”,提高免疫力、增强体质,更健康
- 孩子春节最爱“黄金菜”,补充营养,增强免疫力,身体更健康!
- 过年孩子必须要吃的美食,暖身暖胃、提高免疫力,冬天不生病
- 立冬后,孩子嘴馋的“高钙菜”,补充钙质,增强免疫力,不生病
- 廉东波|《健谈》观点丨浅表性胃炎三五年复查一次 萎缩性胃炎一年一查
- 黑木耳|黑木耳和此食物一起,易清身体中垃圾,提高免疫力,子宫更干净!
