文章图片
▲ 质谱流式细胞技术(CyTOF)对不同处理组中各类肿瘤浸润免疫细胞比例展示
既然αCD73-Dye+NIR处理能够如此显著改变肿瘤微环境中免疫细胞占比 , 那么这种改变是全身性的 , 还是仅仅局限于NIR照射的局部灶呢?这种处理对转移处肿瘤能否也有同样的作用呢?
他们惊讶地发现 , OT-I T细胞不仅在左侧照射侧肿瘤内浸润增多 , 同时右侧未照射侧肿瘤内的浸润也显著增多了!而且小鼠两侧的肿瘤引流淋巴结中CD8 + T细胞均出现明显增殖现象 。
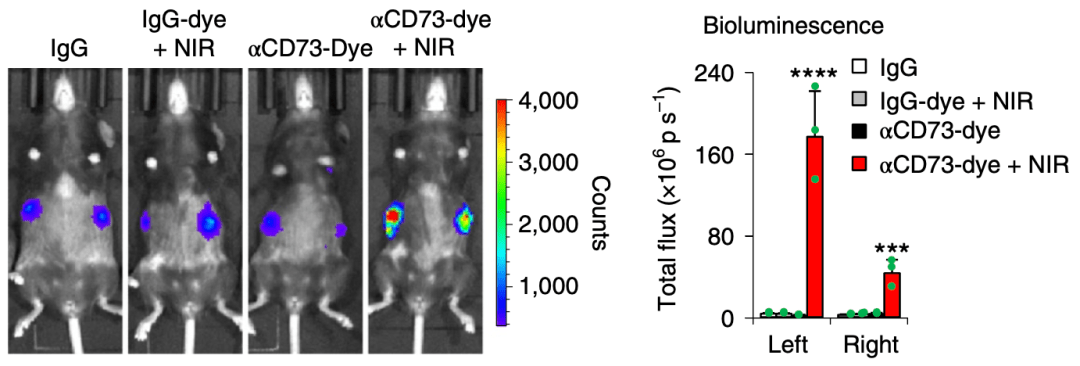
文章图片
▲ α-CD73-Dye+NIR处理使双侧肿瘤和引流淋巴结中CTL浸润增多
除了模拟肿瘤转移 , 鲁勇团队还使用了4T1.2乳腺癌自发性转移肿瘤模型 , 该模型在肿瘤长到一定大小时会自发性地出现肺转移 。 结果显示 ,α-CD73-Dye+NIR处理同样增加了肺部转移瘤中CD8 + T细胞的浸润比例。
【鲁勇|《自然》子刊:全面消除肿瘤中的免疫抑制细胞,终于实现了!】这就说明 α-CD73-Dye+NIR处理引起的改变是全身性的 , 不仅仅局限于照射的局部灶 。
最关键的问题来了 , α-CD73-Dye+NIR处理究竟能不能改善ICB耐药现象呢?
鲁勇团队将α-CD73-Dye+NIR和抗PD1抗体联用(Combo)治疗荷瘤小鼠 , 发现Combo治疗后 ,所有原发肿瘤都被消除 , 没有出现复发现象;而且也明显改善了肺转移情况 , 显著延长小鼠生存期 。
▲ 在Combo治疗后 , 所有原发肿瘤被消除且无复发
之前提到过 , CD73分子主要表达在免疫抑制性细胞和肿瘤细胞表面 , 那么在联合治疗时哪部分细胞才是靶向的关键呢?
鲁勇团队主要做了两个实验回答这个问题 。
首先 , 他们在不表达CD73的胰腺癌模型Panc02中应用Combo治疗 , 结果是效果依然存在 , 肿瘤生长仍然能被完全抑制 , 这就提示了 肿瘤细胞表面的CD73分子并不重要 。
然后他们使用了Nt5e -/- 小鼠 , 其肿瘤浸润的免疫抑制性细胞表面CD73缺失 , 结果发现Nt5e -/- 小鼠的肿瘤在治疗后期再次出现耐药现象 。 这就说明 ,免疫抑制性细胞表达的CD73才是联合治疗的关键 。
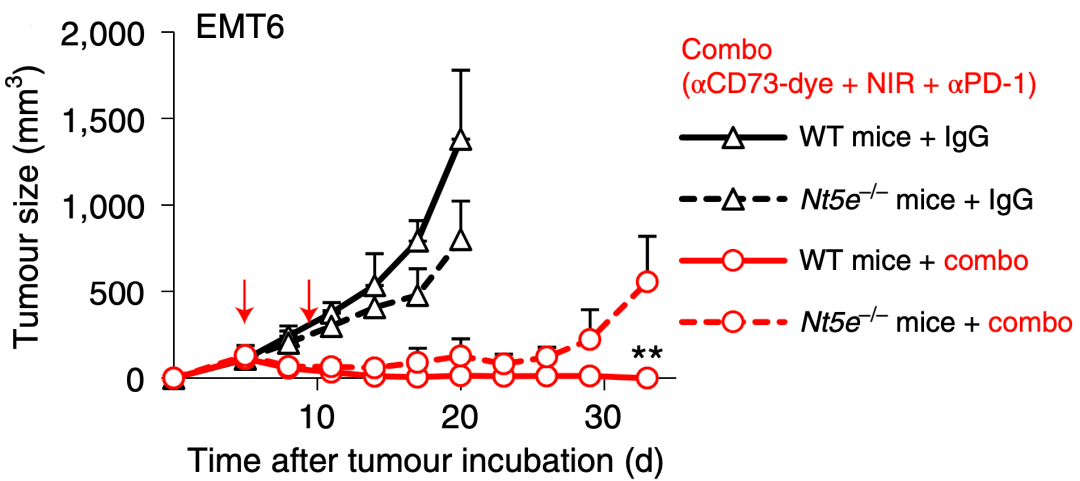
文章图片
▲ Nt5e -/- 小鼠的肿瘤在Combo治疗后期再次出现耐药现象
总而言之 , 这个研究揭示了ICB免疫疗法获得性耐药的潜在机制 , 并提出了一种克服的策略 , 即通过α-CD73-Dye光敏抗体+NIR辐照局部去除所有免疫抑制性细胞 , 从而杀伤肿瘤 。
一旦这个疗法用于临床 , 使用场景也非常广泛 。局部NIR辐照可以直接靶向治疗一些浅表肿瘤 , 如皮肤癌、头颈癌和乳腺癌 。 此外对体内肿瘤如胰腺癌来说 , NIR辐照可以在内窥镜引导下通过光纤扩散器进行 , 靶向特定肿瘤部位并减少对正常细胞的潜在损伤 。

文章图片
参考文献:
[2]. Li P, Spolski R, Liao W, et al. BATF-JUN is critical for IRF4-mediated tranion in T cells. Nature. 2012;490(7421):543-546. doi:10.1038/nature11530
[4]. Tuit S, Salvagno C, Kapellos TS, et al. Tranional Signature Derived from Murine Tumor-Associated Macrophages Correlates with Poor Outcome in Breast Cancer Patients. Cell Rep. 2019;29(5):1221-1235.e5. doi:10.1016/j.celrep.2019.09.067
- 卫生室|《乡村医生诊疗口袋书(先行本)》面世
- 解读|《浙江省医院门诊管理办法》政策解读
- 廉东波|《健谈》观点丨浅表性胃炎三五年复查一次 萎缩性胃炎一年一查
- 家长|杭州《青少年皮肤健康状况调研》发布,近半青少年受皮肤疾病困扰
- 公报,监测,国民,体质|一图读懂《第五次国民体质监测公报》
- 感冒|《气血运行影响心脏功能——心悸篇》
- 幽门螺杆菌感染|《健谈》观点丨突然消瘦、胃痛、黑便,应及时做胃镜检查
- 数据|《胃肠病学》:减肥防早发肠癌,要从20岁开始!科学家发现,20、30岁和约45岁时肥胖,与结直肠癌发病风险上升88-156%有关
- 糖尿病|糖尿病的“福音”终于被找到了,每天吃一点,“血糖”自然降下来
- 医学|科普连载:《氢气医学人群试验》(漫画版)孙学军教授 序言
