免疫检查点抑制剂(ICB)目前已经应用于多种肿瘤的临床治疗中 , 但是 , 很多对ICB有反应的肿瘤在治疗后期会出现耐药现象 。
出现这种现象的原因之一是 , 肿瘤微环境中存在大量免疫抑制性细胞 , 如髓源性免疫抑制细胞(MDSC)、肿瘤相关巨噬细胞(TAM)和调节性T细胞(Treg)等 ,它们会显著抑制细胞毒性淋巴细胞(CTL)的浸润和功能 , 导致肿瘤继续生长 。
但是目前并不清楚免疫抑制性细胞具体是如何导致ICB获得性耐药的 , 也 没有去除这群细胞的特异性干预手段和药物 。
近日 , 美国 北卡罗来纳州维克森林浸信会健康综合癌症中心的鲁勇团队 , 在《自然》旗下著名子刊《自然·生物医学工程》杂志上发表重要研究成果[1] 。
他们通过数据库筛选出 在免疫抑制性细胞上特异表达的基因Nt5e(编码CD73蛋白) 。 他们 设计了IR-700染料偶联的光敏抗CD73抗体 , 靶向杀伤表达CD73分子的肿瘤浸润免疫抑制性细胞 , 从而显著改善ICB治疗耐药现象 。
据了解 , 这项研究 首次实现了全面消除肿瘤中浸润的免疫抑制性细胞 , 找到了一个克服ICB治疗中获得性耐药的有效策略 , 具有重要的转化意义 , 为将来临床试验奠定了重要的基础 。

文章图片
▲ 论文首页截图
ICB能够使肿瘤特异性T细胞重新活化 , 恢复它杀伤肿瘤的能力 , 因此这个疗法广泛应用于多种肿瘤的临床治疗中 。 遗憾的是 , ICB治疗效果十分有限 , 比如在三阴性乳腺癌(TNBC)中有效率仅有4.7%;而且部分肿瘤还存在获得性耐药现象 , 在治疗后期肿瘤重新生长变大 。
肿瘤中浸润的免疫抑制性细胞是肿瘤对ICB治疗耐药的重要推手 , 它们会抑制CD8+T细胞功能 , 促使肿瘤生长 。目前也有一些削弱这群细胞抑制T细胞功能的方法 , 但往往缺乏特异性 , 无法保证其他免疫细胞不受影响 。
为了解决这些问题 , 鲁勇团队再次把目光集中到肿瘤中浸润的免疫抑制性细胞 , 他们从已发表的微阵列数据库[2-4]中筛选出11个基因 , 相比于其他免疫细胞 , 这11个基因在免疫抑制性细胞中特异性高表达 , 其中 表达差异倍数最高的是基因Nt5e(编码CD73蛋白) 。
通过流式细胞技术分析 , 鲁勇团队发现: CD73分子不仅在免疫抑制性细胞上高表达 , 在一些肿瘤细胞(如4T1.2 , EMT6)中也会表达 , 但是在CTL、NK及DC细胞中几乎不表达 。
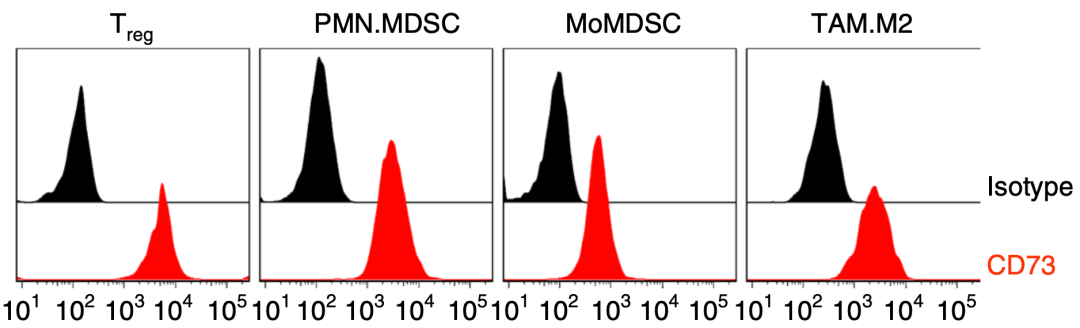
文章图片
▲ 基因Nt5e(红色)在免疫抑制性细胞中高表达
在免疫抑制性细胞上找到特异性表达的分子之后 , 鲁勇团队就想:如果能特异性杀死这些细胞 , 或许就能消除肿瘤的免疫逃逸 。
因此 , 他们通过一种现有的 近红外(NIR)光耗竭靶细胞的方法 , 设计了一种IR-700染料偶联的抗CD73单克隆抗体(αCD73-Dye偶联物) 。 实验结果表明 , αCD73-Dye偶联物能够与CD73 + 细胞特异性结合 , 并 在NIR(690nm)暴露下高选择性地诱导CD73+ 细胞坏死性死亡 , 而不会损坏相邻细胞 。
那么这个抗体的真实杀伤力怎么样呢?
体外实验结果显示 , 在NIR的作用下 , αCD73-Dye能够快速杀伤免疫抑制性细胞 , 以及表达CD73分子的肿瘤细胞 。
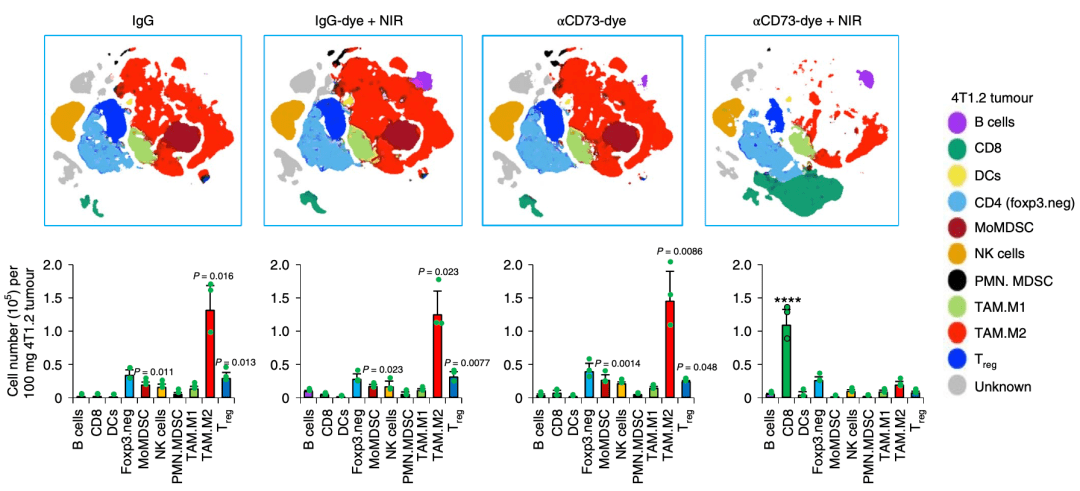
体内实验结果显示 ,αCD73-Dye+NIR处理能够显著降低肿瘤中Treg , MDSC及TAM.M2等免疫抑制性细胞浸润 , 同时明显提高肿瘤浸润CD8 + T细胞占比 , 重新塑造肿瘤中免疫细胞的浸润比例。
- 卫生室|《乡村医生诊疗口袋书(先行本)》面世
- 解读|《浙江省医院门诊管理办法》政策解读
- 廉东波|《健谈》观点丨浅表性胃炎三五年复查一次 萎缩性胃炎一年一查
- 家长|杭州《青少年皮肤健康状况调研》发布,近半青少年受皮肤疾病困扰
- 公报,监测,国民,体质|一图读懂《第五次国民体质监测公报》
- 感冒|《气血运行影响心脏功能——心悸篇》
- 幽门螺杆菌感染|《健谈》观点丨突然消瘦、胃痛、黑便,应及时做胃镜检查
- 数据|《胃肠病学》:减肥防早发肠癌,要从20岁开始!科学家发现,20、30岁和约45岁时肥胖,与结直肠癌发病风险上升88-156%有关
- 糖尿病|糖尿病的“福音”终于被找到了,每天吃一点,“血糖”自然降下来
- 医学|科普连载:《氢气医学人群试验》(漫画版)孙学军教授 序言
