镰状细胞病是一种由β-珠蛋白基因点突变引起的进行性遗传病 , 发病率和早期死亡率较高 。 镰状血红蛋白的产生和聚合导致红细胞镰变 , 临床表现为慢性溶血性贫血、血管病变和血管阻塞[1,2] 。
目前治疗镰状细胞病的方法主要为终身接受姑息性治疗 。异基因造血干细胞移植可能是一种潜在的治疗方法 。 然而 , 由于匹配供者缺乏、免疫并发症以及移植相关的发病率和死亡率 , 造血干细胞移植治疗的使用受到限制[3,4] 。
LentiGlobin (bb1111 , lovotibeglogene autotemcel)是一种基因疗法 , 通过慢病毒载体BB305将编码β A-T87Q -珠蛋白的基因转染至患者自身的造血干细胞(HSCs)后 , 进行自体造血干细胞移植 。
移植后红细胞可以产生抗镰状血红蛋白(HbA T87Q ) , 异常镰状血红蛋白(HbS)的比例降低 。LentiGlobin基因治疗加自体造血干细胞移植的治疗方法 , 可以避免对供者的依赖以及异基因造血干细胞移植相关的免疫并发症 。
近期 , 美国Bonner博士团队 , 在《新英格兰医学杂志》报道了一个特殊的病例: 一名25岁的镰状细胞病(βS/βS型)患者在2015年接受LentiGlobin基因治疗 , 5.5年后又被诊断为急性髓系白血病微分化型(AML , M0) , 最终死于疾病进展和相关并发症[5] 。
我们都知道 , 基因治疗存在一定的致癌风险 。 那这名患者患白血病的真相究竟如何呢?

文章图片
▲ 论文首页
接下来 , 我们就一起来看看Bonner等人如何破解这一迷案 。
从患者的病历来看 , 这名女性患者确诊后 , 因 长期接受羟基脲治疗 , 仍反复出现血管阻塞危象 , 导致其频繁住院 。
在2015年8月(25岁) , 患者被纳入HGB-206队列研究的A组 , 接受了最早期的LentiGlobin基因治疗 。 回输CD34 + 造血干细胞(每公斤体重2.6×10 6 个 , 其中CD34 hi HPSC每公斤体重1.5×10 6 个 , 每二倍体基因组的平均载体拷贝数[VCN]为0.57拷贝) 。 治疗后第16天 , 患者因发热接受粒细胞集落刺激因子治疗 , 中性粒细胞和血小板分别于移植后19天和31天植活 。
接受治疗6个月后 , 外周血中每二倍体基因组的VCN为0.05拷贝 , HbA T87Q 占总非输注血红蛋白的4.33% 。 镰状细胞病溶血、血管闭塞危象、慢性疼痛等症状持续存在 , 因此患者仍需接受羟基脲治疗和红细胞输注 。 这个结果表明 ,基因修饰细胞移植量低 , 转基因表达量低时 , 临床效益最小 。
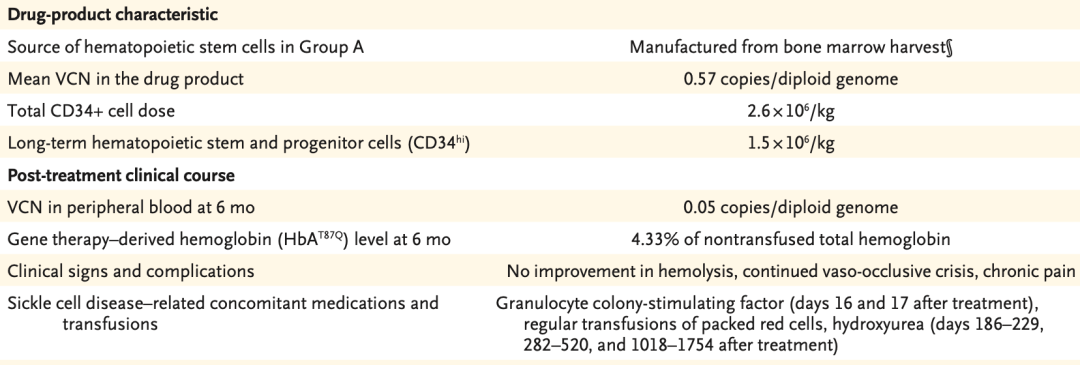
文章图片
▲ 治疗特点和治疗后的临床特征
在2020年12月 , 患者因血管阻塞危象入院 , Bonner团队注意到 患者外周血中有2%的原始细胞 , 这被认为与感染后的恢复有关 , 在随后的血象检查中没有发现原始细胞的存在 。
2021年1月 , 患者出现中性粒细胞减少 , 2021年2月 ,患者外周血原始细胞占29% , 骨髓原始细胞占22-50% , 确诊为急性髓系白血病微分化型(M0) 。
Bonner团队分析了患者的样本 , 发现患者 骨髓细胞中存在RUNX1移码突变和PTPN11错义突变 , 以及7号染色体单体和染色体11p部分缺失 。
进一步研究发现 , 外周血CD34 + 细胞中有92.1%为慢病毒载体阳性 , 骨髓CD34 + 细胞中慢病毒载体阳性细胞占86.7% 。 因此 , 研究人员猜测 患者的急性髓系白血病可能与她接受的基因治疗有关 。
▲ 原始细胞中载体表达
诊断为急性髓系白血病后 , 患者接受了三个周期的诱导化疗 , 取得形态学缓解 , 但微小残留病阳性 , 原始细胞占0.2% 。
- 遗传性视网膜眼病是儿童及工作年龄人群致盲的首要病因|为被遗忘的盲人打破天价药垄断!市一医院开启中国首个先天性黑蒙基因治疗研究
- 基因治疗|中国自主研发基因治疗眼科新药步入“转化快车道”
- 小易(化名)今年只有11岁|太阳下山他们眼里的世界消失不见?有望重新点亮!中国首个先天性黑矇基因治疗临床研究开启
- 治疗|基因治疗在IVA型粘多糖病中的应用
- 医科大学|聊城市退役军人医院成功举办外周血管疾病学术年会
- 陈子江院士团队NEJM研究:常用的第三代试管婴儿技术,未必提高活产率
- 糖尿病外周血管病变的诊断与治疗
- 乔治全球健康研究院|低钠盐是智商税?NEJM:低钠盐降低卒中风险14%
- 外周血|交通污染或可导致外周血多条通路出现紊乱
- 外周血|最新研究:交通污染或致人体多条通路紊乱而致病
