【技术|《自然》子刊:可扩增筛选肿瘤新抗原特异性T细胞的技术,终于出现了!】TIL中有一部分是以肿瘤特异性新抗原为靶点的T细胞 , 这部分细胞具有很强的肿瘤杀伤能力 。 然而实际上 ,TIL的数量很少 , 且常常在肿瘤微环境中被抑制 。

文章图片
论文首页截图
那么 , 是否可以找到一种更加特异的扩增方法呢?
Harari、Coukos和他们的同事从抗原呈递过程中得到了启发 。 抗原呈递细胞(APC)向T细胞呈递肿瘤相关的抗原 , 并可驱动这些T细胞的激活和增殖 。 那么 , 是否可以 基于自体APC对肿瘤中的TIL进行抗原选择性扩增呢?
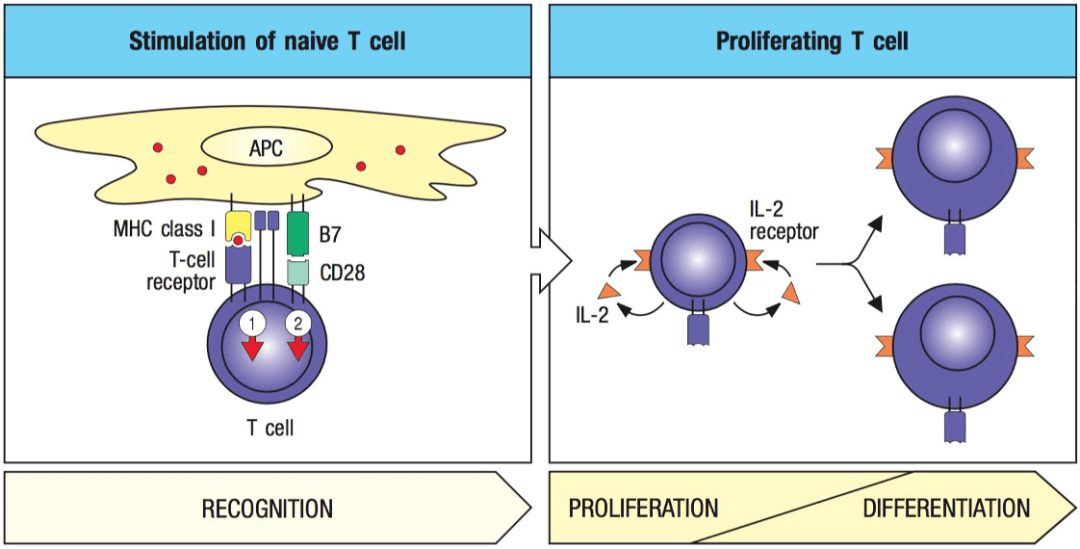
文章图片
(图片来源:Janeway's Immunobiology)
说到APC细胞 , 大家最先想到的可能是树突状细胞 , 然而在这项技术中 , 研究人员 选择了B细胞作为APC , 因为相对于树突状细胞 , B细胞更容易获取和扩增 , 而且更容易进行基因编辑 。
研究人员首先分析了肿瘤细胞的基因组来鉴定蛋白质的随机突变片段 , 这些蛋白质片段可以作为新抗原被呈递 。 接下来 , 他们用这些蛋白质片段刺激改造后的B细胞 , 或者将编码这些片段的DNA转入B细胞中 , 让B细胞来呈递这些抗原 。 最后 , 他们将B细胞与肿瘤细胞以及从肿瘤中分离出来的TILs进行共培养 。
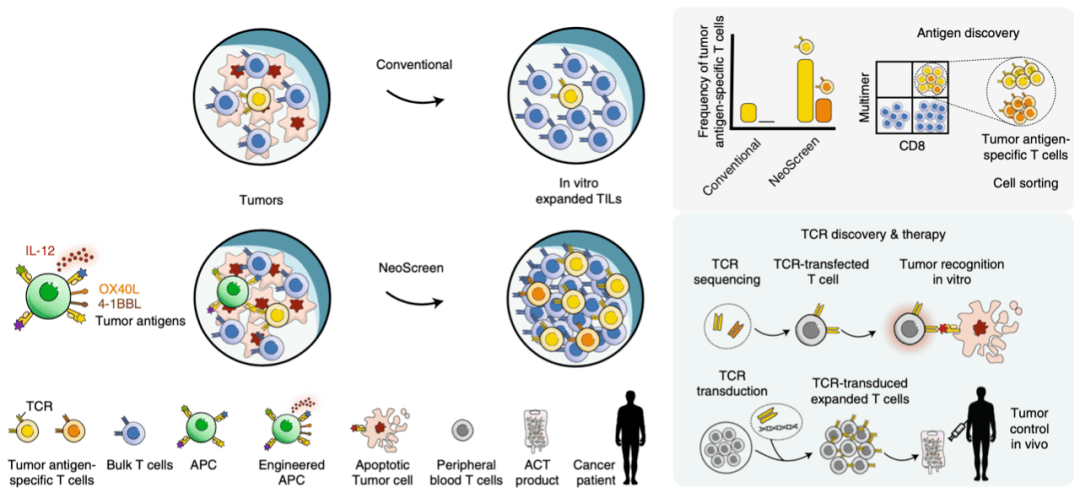
文章图片
NeoScreen的工作流程及其与传统方法的比较
结果发现 , NeoScreen在7例患者中鉴定了19个抗原表位 。 这19个表位中有9个表位 ,在NeoScreen中观察到的特异性TILs频率显著高于传统扩增方法 。 更重要的是 , 另外10个肿瘤抗原特异性TILs仅在NeoScreen中发现 。
不过 , NeoScreen要做的不仅限于此 , 更重要的是 , NeoScreen对于基于TCR的个体化过继T细胞疗法(ACT)还有着重要意义 。
简单来说 , ACT是指从患者体内分离T细胞 , 并在体外进行扩增 , 然后再回输到患者体内 , 从而达到杀伤肿瘤的目的 。 如果我们可以 通过NeoScreen获得新抗原特异性的TCR , 并将它们在患者的其他T细胞中表达 , 这样就能获得大量靶向肿瘤的T细胞 。
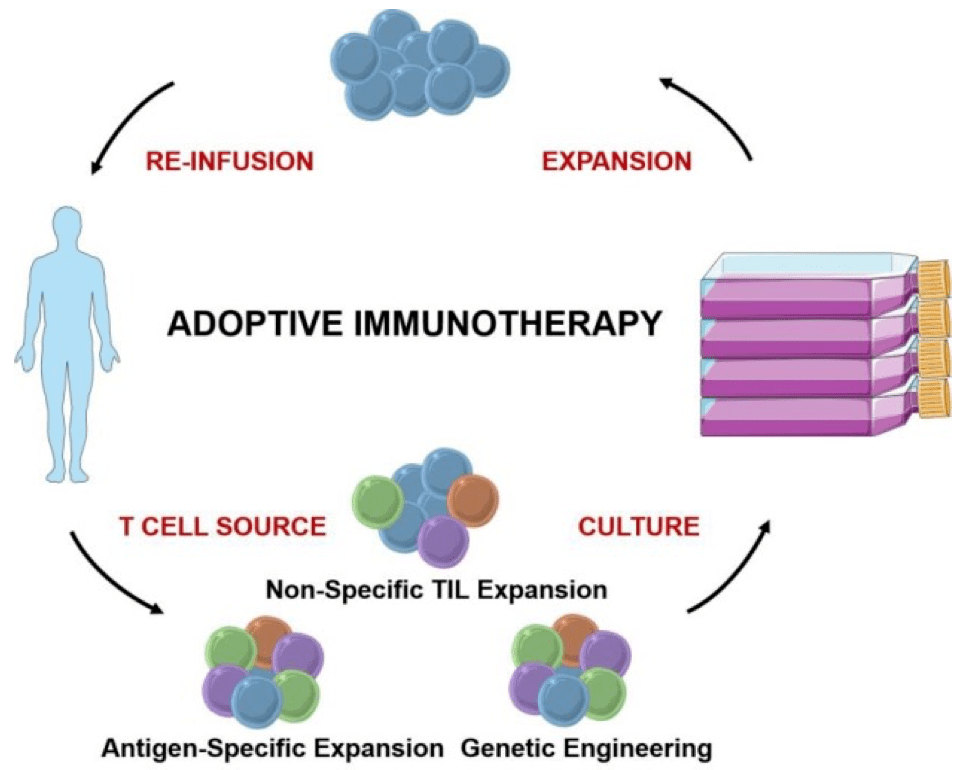
文章图片
ACT治疗流程示意图[3]
体外实验表明 ,将TCR克隆进活化的原代T细胞中后 , 所有通过NeoScreen发现的针对新抗原的TCR均具有肿瘤反应性 。
进一步地 , 研究人员通过小鼠异种移植瘤模型发现 , 在给小鼠过继回输表达新抗原特异性TCR的T细胞后 , 肿瘤的生长得到了显著抑制 。
因此 ,NeoScreen鉴定的抗原特异性TCR在体外和体内试验中均表现出抗肿瘤反应 , 说明NeoScreen在基于TCR的个体化ACT治疗中具有良好的应用前景 。
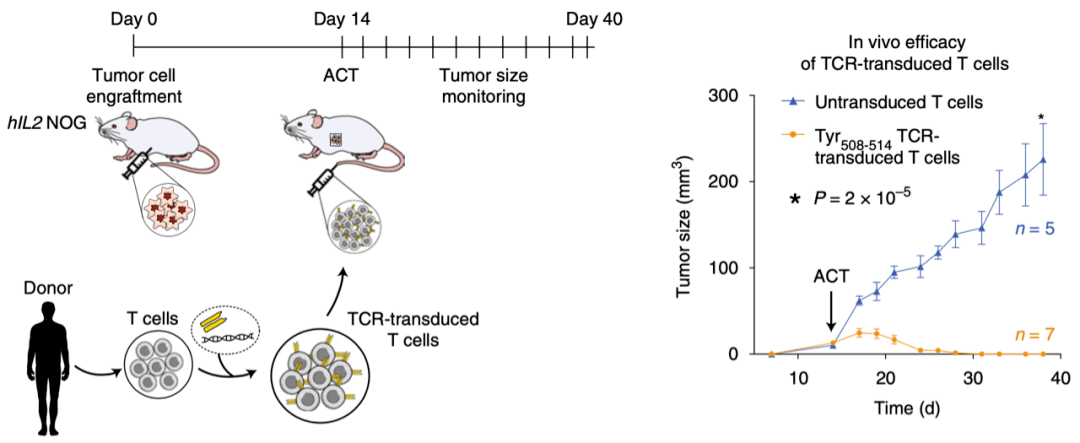
文章图片
TCR转导的T细胞在患者来源的异种移植瘤模型中表现出良好的抗癌效果
总的来说 , 这项研究报道了一种能够高度敏感地筛查肿瘤新抗原的方法 ,相比于传统手段 , 这一方法可以更加有效地扩增肿瘤新抗原特异的TIL 。
此外 , 这一方法 还能够高度敏感地鉴定肿瘤反应性TCR , 从而为个性化改造T细胞 , 实现更加精准高效的肿瘤打击提供了可能 。
本文的作者Coukos还提到:“NeoScreen还可以用于设计个性化的癌症疫苗 , 我们将进一步测试NeoScreen在癌症免疫治疗方面的这些应用 。 ”
- 卫生室|《乡村医生诊疗口袋书(先行本)》面世
- 解读|《浙江省医院门诊管理办法》政策解读
- 廉东波|《健谈》观点丨浅表性胃炎三五年复查一次 萎缩性胃炎一年一查
- 家长|杭州《青少年皮肤健康状况调研》发布,近半青少年受皮肤疾病困扰
- 闭塞|长沙市第四医院:新技术让糖足不再在“截”难逃
- 随着人民生活水平的提高和医疗技术的不断进步|健康科普堂 | 冬季以合理膳食“抵御”老年病,你做对了吗?
- 江湖郎中|南昌不育不孕哪个医院好 南昌华儿山专业技术为您服务
- 公报,监测,国民,体质|一图读懂《第五次国民体质监测公报》
- 菏泽市|菏泽市妇幼保健院与山东大学第二医院技术协作医院正式揭牌
- 感冒|《气血运行影响心脏功能——心悸篇》
