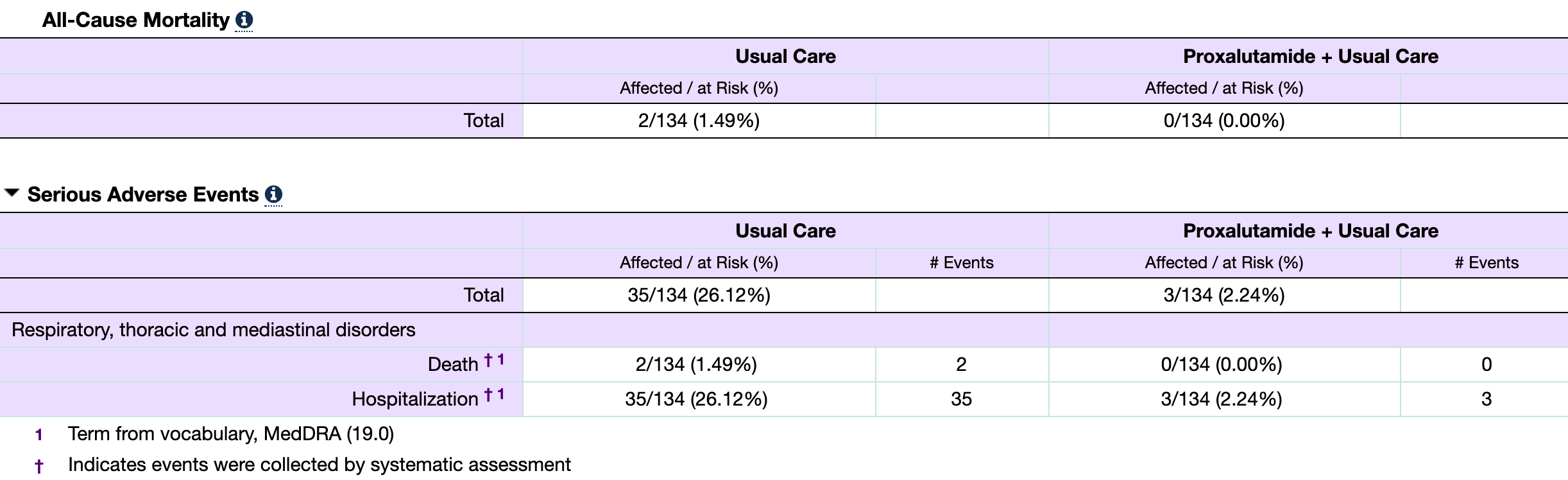
数据|新冠口服药即将问世?四季度关注这4家公司3期临床揭盲 | 见智研究所( 五 )
预计主要完成时间:2021年8月3日
4、PF-07321332——辉瑞
辉瑞除了在新冠疫苗上大放异彩 , 口服药方面也取得快速突破 , 华尔街见闻·见智研究所曾在文章中专门分析过PF-07321332 。
PF-07321332是一款3CL蛋白酶抑制剂 , 它在多种冠状病毒的生命周期中起到重要作用 , 其潜在优势是对目前所有的新冠病毒变种都可以产生作用 。
PF-07321332单药在分子水平对新冠病毒的抑制活性IC50为19nM , 在可表达ACE2蛋白的人气道上皮细胞、HeLa和A549细胞中PF-07321332单药对病毒抑制活性EC50分别为62、99和56nM , 表现出良好的抗病毒活性 。
文章图片
华尔街见闻·见智研究所认为 , 辉瑞的PF-07321332具备广谱抗新冠病毒能力 , 意味着其潜力很大 , 虽然理论上病毒仍可能发生变异逃过其作用机制 , 但实际发生的机会很小 。 辉瑞在业绩电话会上同样认为该药物有望在今年4季度获得EUA , 目前临床试验中辉瑞采用的是PF-07321332+利托那韦的联合疗法 。
主要临床试验进展:
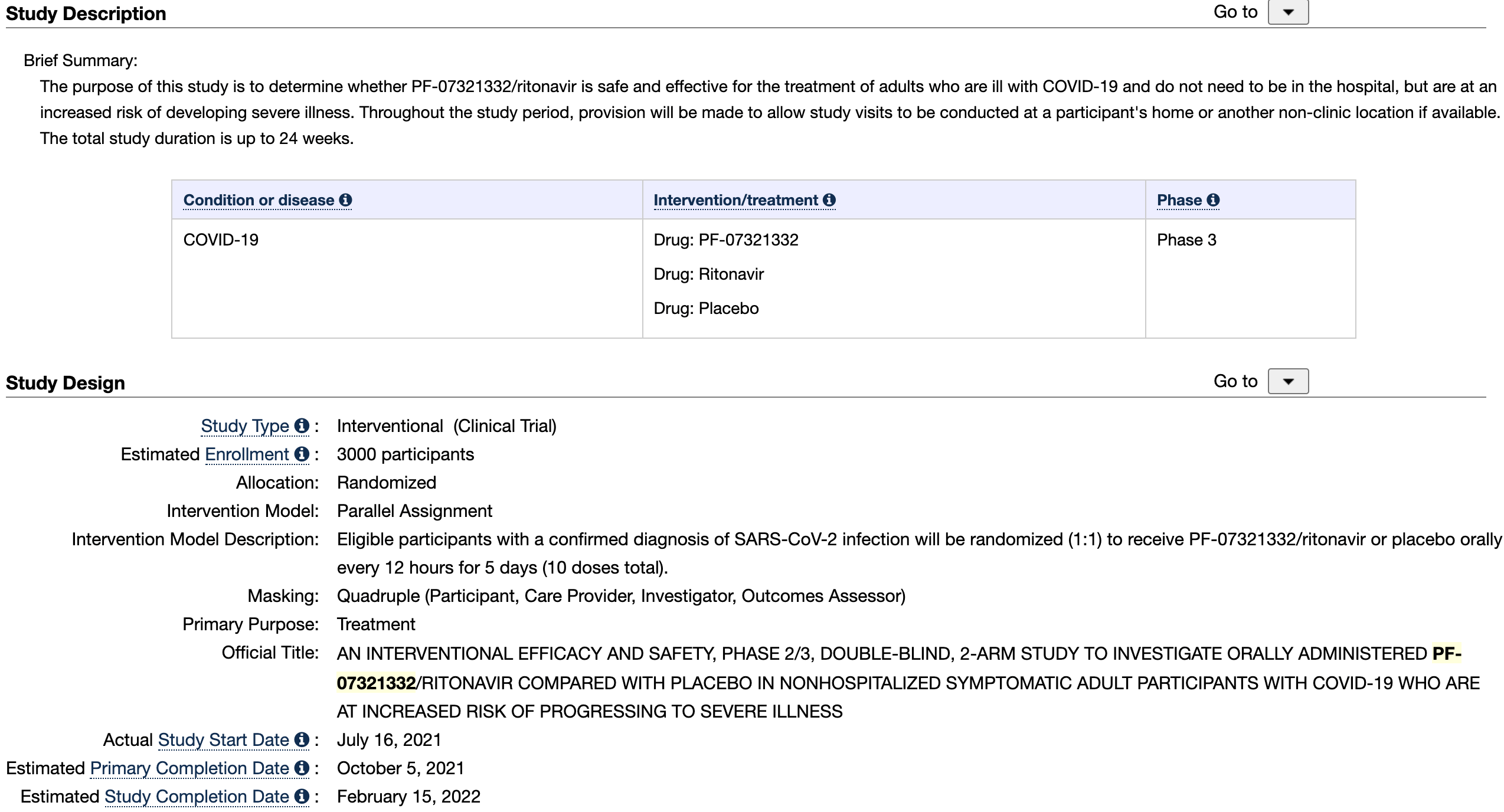
美国注册 , 针对门诊新冠轻中症患者的临床3期试验(正在进行)
9月1日 , 辉瑞公告完成新冠药物PF-07321332的轻症2/3期临床首例患者入组给药 。
文章图片
研究方式:该研究是多中心试验 , 比较PF-07321332/利托那韦与安慰剂针对轻中型成新冠患者疗效 。 约3000名受试者将随机分配到实验组和安慰剂组 。
入组标准:出现症状后5天内有一种或多种轻度或中度症状与COVID-19相关的症状 。 总研究时间长达24周 。
主、次要终点:主要终点:因任何原因导致COVID-19相关住院或死亡的参与者比例[时间范围:第1天至第28天] 。 次要终点:PF-07321332/利托那韦相对于安慰剂的不良事件(AE)和严重不良事件(SAE)的发生率[时间范围:第1天至第34天];新冠迹象/症状的持续/严重时间[时间范围:第1天到第28天]
预计主要完成时间:2021年10月5日
- 治疗|糖尿病服药后,出现的低血糖比较严重怎么办?
- 全球疫情|如有新冠相关表现 早就诊 不自行服药
- 发热|北京市新增本土病例曾出现发热等症状 自行服药未就诊
- 数据|推动惠民利民数字健康应用,人民数据与健交科技达成战略合作
- 数据|《胃肠病学》:减肥防早发肠癌,要从20岁开始!科学家发现,20、30岁和约45岁时肥胖,与结直肠癌发病风险上升88-156%有关
- 气道|老年人吃饭服药应注意啥?请看这里!
- 北京新增一例新冠确诊病例,曾自行服药,活动轨迹曝光!
- 代谢产物|吸烟+服药=?这些不良影响是真的!
- 新冠|韩国正式供应新冠口服药
- 并发症|高血压一开始服药就不能停?只有两种情况需要,这种情况没必要
