
文章图片
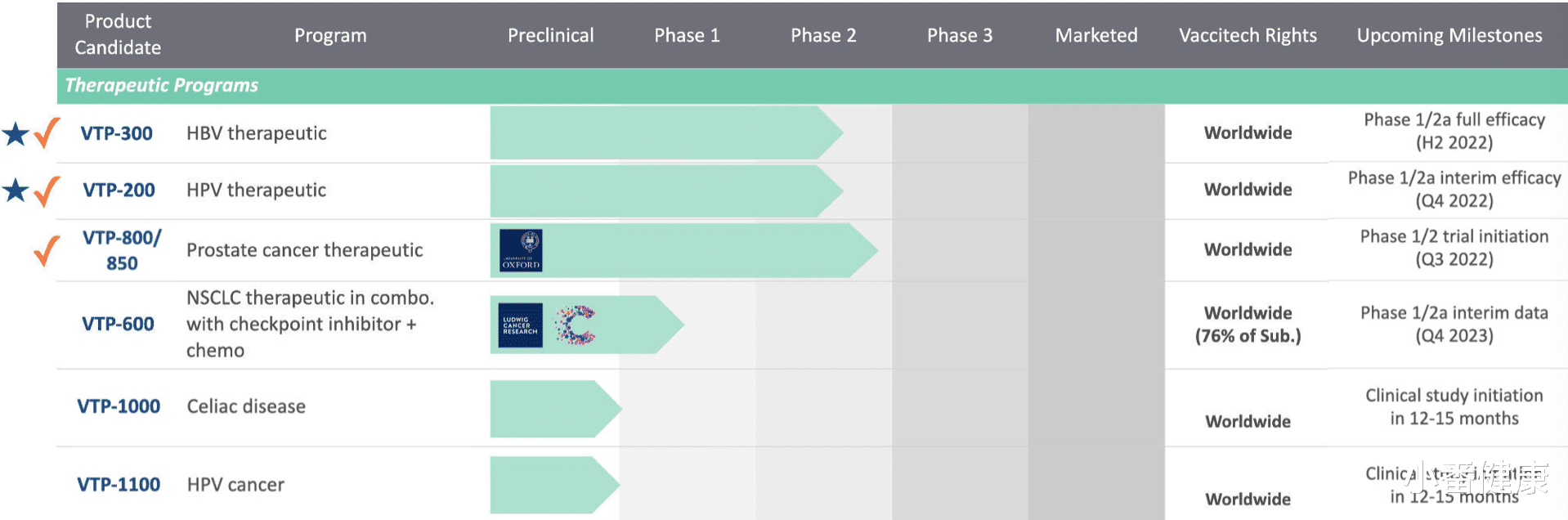
在2022年欧肝会上(EASL2022) , 研究人员介绍了在研乙肝新药VTP-300 Ib/IIa期最新临床开发数据 。 该研究指在经使用核苷(酸)类似物(NA)病毒抑制慢性乙肝受试者(CHB)中 , 接种异源 ChAdOx1-HBV/MVA-HBV 治疗性疫苗 (VTP-300) 联合低剂量 nivolumab (LDN)的 Ib/IIa 期研究 。
乙肝在研新药VTP-300 , 联用低剂量nivolumab , Ib/IIa期新进展
研究人员认为 , 若想实现慢性乙肝(CHB)的功能性治愈 , 可能需要诱导 CD8+T细胞对HBV的应答 。 迄今为止 , 在人体中获得的最大规模 CD8+T 细胞应答是由复制能力低下的腺病毒载体诱导的 , 然后是减毒的痘病毒加强免疫 。
Vaccitech公司与牛津大学正在合作开发一种研究阶段治疗性乙肝疫苗(VTP-300) , 该候选疫苗使用到一种黑猩猩腺病毒载体(ChAdOx1-HBV)和一种经改良的安卡拉增强疫苗(MVA-HBV) , 编码来自共有基因型C病毒的灭活聚合酶、核心和整个大 S 区 。
一项 Ib/IIa 期临床试验纳入多达 52 名慢乙肝受试者(每组 10-16名) , 这些受试者已经接受了抗病毒药物治疗至少一年 , 且 VL 检测不到 , 乙肝表面抗原(HBsAg)< 4000 IU 。
第1组 , MVA-HBV (1 x 10*8 pfu) , 第28天后采用同源 MVA-HBV;第2组 , ChAdOx1-HBV(2 x 10*10 病毒颗粒)随后在第28天进行MVA;第3组 , 与第2组相同 , 在第28天使用低剂量的 nivolumab (LDN)(0.3 mg/kg IV);第4组与第2组相同 , 在第0天和第28天使用 LDN 。
在接种该候选疫苗的前后(第7天、第28天、第35天、第84天和第168天) , 使用一种跨越HBV免疫原的基因型C和D HBV肽的 IFN-γ ELISpot 方法评估该疫苗引起的HBV特异性T细胞应答 。
Vaccitech公司的异源初免-加强策略涉及两种不同的载体ChAdOx和MVA , 它们编码相同的抗原 , 来自Vaccitech用ChAdOx第一次免疫可有效启动?T细胞对抗目标抗原 , 用MVA第二次免疫增强并扩大了T 细胞对靶抗原的反应 。
截至2022年3月1日 , 该试验已有 40 名受试者入组 , 没有报告相关的安全信号或疫苗相关的 SAEs 。 在 2 名受试者中 , 观察到与 SAg 下降相关的转氨酶耀斑 。 第2组和第3组 , 在第3个月时出现了 SAg 降低 。 第2组中 , 只有初始 SAg 较低的受试者出现了效果 , 而第3组中几乎所有受试者都显示 SAg 下降(前6个月已调降 1 log10 );
迄今为止 , 在 20 名受试者中评估了HBV基因型C T细胞反应 , 靶向HBV核心(8/20)、sAg(17/20)和 pol(8/20) , 基线时平均幅度分别为 217、213 和 118 x SFU/10? PBMC(平均总幅度为 363 SFU) 。
在初次接种该候选疫苗后(第7天或第28天) , 第1-4组的HBV特异性T细胞的峰值平均幅度分别为 437、244、688、332 SFU/10?。 在加强疫苗接种高峰(第35天)后 , 第1-4组的HBV特异性T细胞应答总数分别为 344、689、689、277 SFU/10? 。
有 13 名受试者在初免后和 16 名受试者在加强后的反应较基线有所增强 。 大多数受试者的反应 , 持续了 3-6个月 。 HBV基因型交叉反应性T细胞反应与基因型D肽具有高度交叉反应性 。
综上所述 , 研究人员给出截至今年3月1日有关VTP-300+nivolumab 组合疗法用于经NA治疗并获得病毒学抑制慢乙肝受试者的 Ib/IIa期试验结论是:作为一种研究阶段的新型免疫疗法 , VTP-300无论是单药治疗还是在加强时间点与 nivolumab联用 , 都具有免疫原性 , 且在控制良好的CHB受试者中显示出 SAg 降低 , 同时表现出良好的安全性 。
【乙肝|乙肝在研新药VTP-300,联用低剂量nivolumab,Ib/IIa期新进展】
- 为什么中国癌症高发?不妨多了解下
- 喜报!长沙市口腔医院学生在全国口腔医学教育年会中创佳绩
- 胃黏膜|糖尿病人吃什么坚果好?研究发现核桃能降低糖尿病与心脏病的风险
- 乡村振兴新模式 在青山绿水间洞见幸福维多
- 在希望的田野上 无人机飞防统防统治稳粮增豆保丰收
- “我在上海阳台等你”路牌为什么这么火?上海姑娘这样说
- 糖尿病人吃什么坚果好?研究发现核桃能降低糖尿病与心脏病的风险
- 且行且吟 ▏站在风口上
- 在希望的田野上 | 无人机飞防统防统治 稳粮增豆保丰收
- 乡村振兴新模式丨在青山绿水间洞见幸福维多
