树突状细胞(DCs) , 相信大家并不陌生 , 它有着像树枝一样的不规则触角 , 是功能最强的专职抗原提呈细胞 , 可启动和调节肿瘤微环境中天然免疫和获得性免疫 。
DCs能够在主要组织相容性复合体(MHC)分子上呈递肿瘤相关抗原(TAAs) , 并提供共刺激/可溶性因子促进抗肿瘤T细胞应答[1] , 是抗肿瘤免疫的关键角色 。 因此 , 在众多的临床试验中 , 科学家们 已经开发了许多种类的DCs靶向疫苗来提高癌症的免疫治疗效果[2,3] 。
向DCs 靶向递送抗原和佐剂是发展DCs疫苗的重要途径[4] 。 然而 , 由于DCs靶向受体 , 如DEC205和DC-SIGN并不是唯一表达在肿瘤浸润性的DCs上 , 这会导致非特异性的免疫系统被激活 , 引发潜在的副作用[5,6] 。 此外 , 确定最佳的免疫优势肿瘤抗原 , 如TAA、TSA , 和患者特异性的新抗原也面临着挑战[7] 。 解决这些问题对于DCs疫苗在临床上的推广至关重要 。
近日 ,武汉大学中南医院汪付兵和华科同济医学院附属武汉儿童医院袁纯辉团队 , 在著名期刊 Molecular Cancer 上发表了有关 新型DCs靶向疫苗用于乳腺癌治疗的重要研究成果 , 为癌症治疗提供了新的思路 。

文章图片
▲ 论文截图
众所周知 ,免疫原性细胞死亡(ICD)可以增加肿瘤抗原的暴露 , 促进免疫刺激肿瘤细胞内容物的释放 , 有利于DCs摄取垂死的肿瘤细胞[8] 。 因此 , 在肿瘤细胞中诱导ICD将是维持DCs充分暴露于肿瘤抗原 , 解决寻找最佳免疫优势抗原问题的有效途径 。
但是 , DCs在肿瘤微环境(TME)中通常表现出较低的成熟度 , 在呈递肿瘤抗原方面效果较差[9] 。 驱动免疫原性DCs激活的佐剂 , 特别是TLR3激动剂 , 在诱导1型常规DCs(cDC1s)成熟方面具有非常好的效果 。 因此 ,靶向地将ICD诱导剂和TLR3激动剂导入肿瘤细胞 , 将是原位激活肿瘤浸润性DCs , 并避免非特异性的免疫的理想方法 。
外泌体因其细胞毒性低、最大限度地提高药物的生物利用度和精准的靶向特异性 , 成为人们关注的“天然纳米粒” , 广泛地用作药物递送载体[10] 。 肿瘤来源的外泌体(Texs)可以作为一种无细胞的治疗载体 , 渗透到TME中以实现DCs的原位激活 。α-乳清蛋白(α-LA)是一类在大多数人类乳腺癌中表达的乳腺特异性免疫优势蛋白 , 它可作为特异性肿瘤归巢蛋白在外泌体表面聚集以增强靶向性和免疫原性 。
为了解决DCs靶向疫苗面临的问题、优化治疗方案 , 研究者们 开发出了装载TLR3激动剂Hiltonol和ICD诱导剂中性粒细胞弹性蛋白酶(ELANE)的 α -LA外泌体(HELA-Exos) , 以实现DCs原位激活用于乳腺癌治疗 。
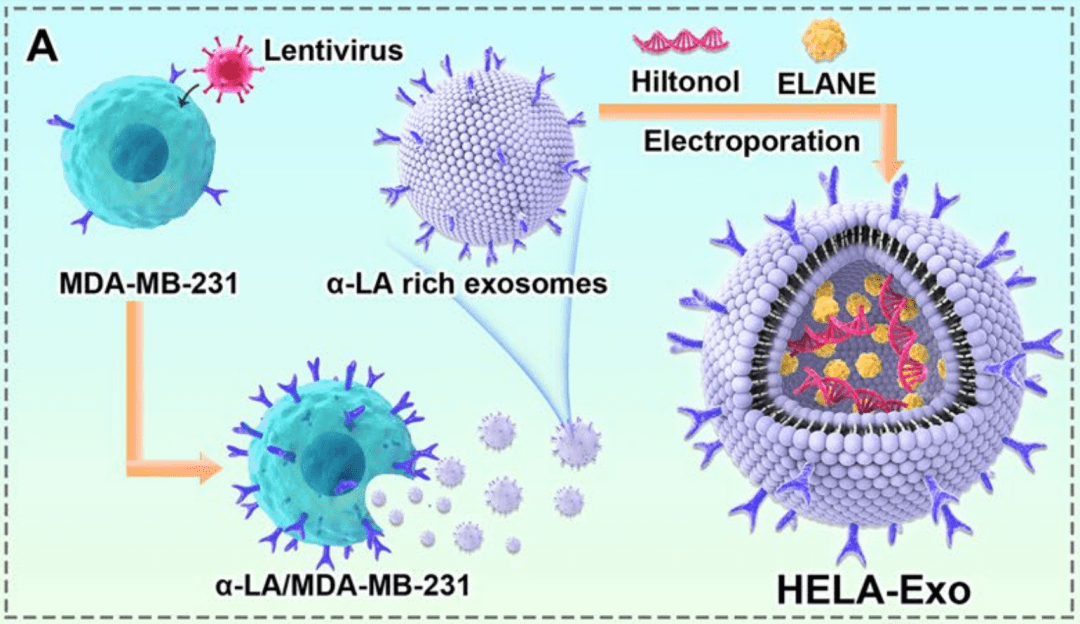
文章图片
▲ DCs靶向疫苗HELA-Exos的构建示意图
为了确定α-LA是否是乳腺癌中的特异性优势表位 , 研究人员首先评估了 α-LA在不同细胞系中的表达 。
正如预测的那样 ,三阴性乳腺癌细胞系MDA-MB-231和非TNBC的其他乳腺癌细胞系表达的α-LA mRNA水平 , 显著高于人乳腺上皮细胞系等其他细胞系 。 随后 , 研究人员构建了载药性能良好、粒径适宜的HELA-Exos纳米制剂 , 可进一步用于体内外研究 。
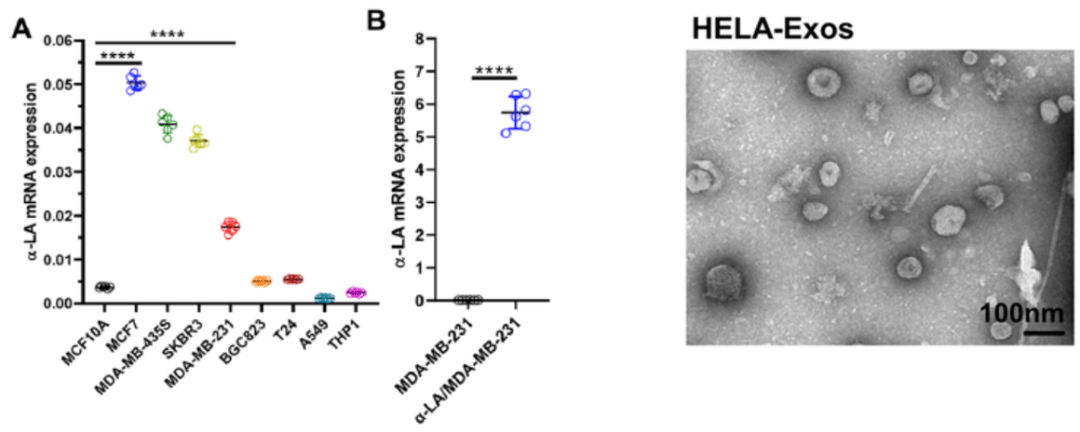
文章图片
▲ 不同细胞系中α-LA mRNA的相对丰度与HELA-Exos透射电镜图
体外靶向性研究表明 , 与Texs相比 , HELA-Exos在乳腺癌细胞系MDA-MB-231中蓄积量显著 , 具有良好的乳腺癌细胞靶向性 。 体外药效实验显示 ,HELA-Exos对不同类型的乳腺癌细胞均表现出显著的杀伤能力 。 同时 , HELA-Exos显著促进了损伤相关分子模式(DAMPs)如钙网蛋白(CRT)的产生 , 在乳腺癌细胞中诱导产生ICD效应 。
- 模式|专家解读:什么是"抗原筛查+核酸诊断"检测模式?
- 感染者|焦作新增本土无症状感染者3例!修武县公布6例新增无症状感染者活动轨迹
- 抗原|“全家捅”来了 上海非重点区域居民在家自测“抗原”
- 抗原|新冠抗原筛查自测怎么做?手把手教学来了!
- 本文转自:上观社区居民新冠抗原筛查自测怎么测?抗原筛查自测好操作吗?有哪些步骤?需要特别...|新冠抗原筛查自测怎么测?教程来了!
- 筛查|上海多区今明两天将开展新冠病毒抗原筛查,教程来了!
- 筛查|上海多区开展新冠病毒抗原筛查。自己捅鼻子?这么操作!
- 市民|沈阳人注意!新冠病毒抗原检测试剂正确操作方式来了!
- 检测|上海今起对重点区域全域封控开展核酸筛查,非重点区域开展抗原检测
- 作用|核酸+抗原筛查将起何作用?吴凡:出结果快、全覆盖,保证流动的人都是阴性的
