随后的细胞实验发现 , 敲除hnRNP K , 能减弱肝癌细胞增殖和迁移侵袭的能力 , 并且还能消除lnc-CTHCC过表达对肝癌细胞增殖和转移的促进作用;而过表达hnRNP K , 则能挽救lnc-CTHCC敲除导致的肝癌细胞增殖和迁移能力的下降 。 另外 , hnRNP K还能调节肿瘤转移相关标志物的表达 。 由此可见 ,lnc-CTHCC通过直接结合hnRNP K参与肝癌的发生和转移 。

文章图片
▲ 免疫沉淀显示lnc-CTHCC和hnRNP K结合( 图d);hnRNP K在肝癌组织中表达升高( 图i);hnRNP K高表达与肝癌患者的预后降低显著相关( 图m);敲除hnRNP K后 , 肝癌细胞增殖(图n和图o)和迁移侵袭(图p)的能力减弱;hnRNP K过表达挽救了lnc-CTHCC敲除对肝癌细胞增殖和转移的抑制作用 (图q);hnRNP K敲除抵消了lnc-CTHCC过表达对肝癌细胞增殖和转移的促进作用( 图r)
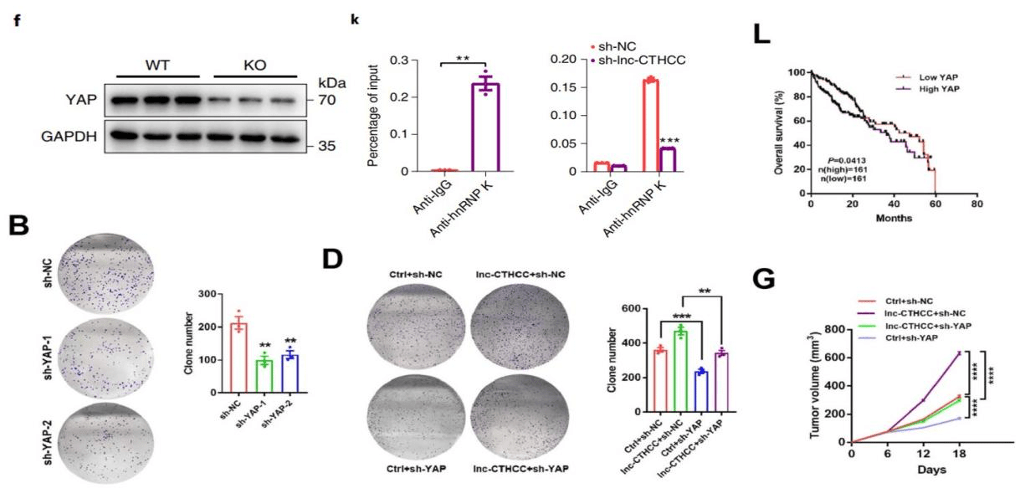
为了进一步确定lnc-CTHCC在hnRNP K后的下游机制 , 研究人员检测了lnc-CTHCC在肝癌中调控的信号通路 , 发现与细胞生长相关的Hippo信号通路 , 在lnc-CTHCC敲除的肝癌组织中明显富集 , 其中 , 通路的核心蛋白YAP1水平显著降低 。
染色质免疫沉淀发现hnRNP K与YAP1启动子区域结合 , 荧光素酶报告基因实验证明敲除hnRNP K能降低YAP1的转录活性 。 这些结果表明 ,在与hnRNP K直接结合后 , lnc-CTHCC募集hnRNP K至YAP1启动子区域 , 促进YAP1转录 。
YAP1作为一种癌基因 , 在多种癌症中表达上调 , 能促进癌症细胞的增殖和存活[6] 。 那么 , lnc-CTHCC是否是通过YAP1来促进肝癌的发生呢?
为了确定YAP1在肝癌中的生物学功能 , 研究人员验证了YAP1在肝癌中的表达水平:YAP1在肝癌组织中高表达 , 高YAP1与总生存率降低显著相关 。 敲除YAP1 , 肝癌细胞增殖和迁移侵袭能力减弱 , 并且能消除lnc-CTHCC过表达对肝癌细胞增殖和转移的增强效应 。 在小鼠肝癌模型中 , YAP1基因敲除能显著抑制lnc-CTHCC诱导的肿瘤生长 。 这些结果表明 ,lnc-CTHCC依赖于YAP1促进肝癌细胞的恶性表型 。
文章图片
▲ lnc-CTHCC敲除后 , YAP1表达降低( 图f);hnRNP K与YAP1启动子区域结合( 图k);高YAP1与肝癌总生存率降低显著相关( 图L);敲除YAP1 , 肝癌细胞增殖减弱(图B) , 并且能消除lnc-CTHCC过表达对肝癌细胞增殖的促进效应(图D);在肝癌小鼠中 , 敲除YAP1抑制lnc-CTHCC诱导的肿瘤生长( 图G) 。
【癌症|《自然·癌症》:南京鼓楼医院团队发现肝癌发病新机制】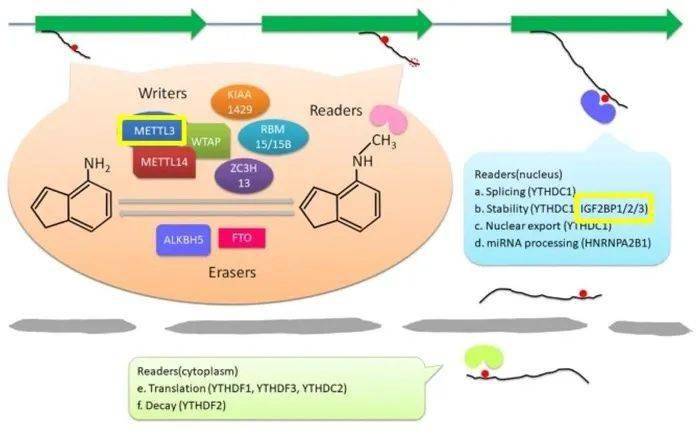
文章图片
▲ m6A修饰的功能(黄框所示为本文涉及的三个相关蛋白)
研究人员发现 , 作为一种lncRNA , 在肝癌中 ,lnc-CTHCC的m6A修饰水平显著上升 。 敲除或过表达METTL3 , 能相应地下调或上调lnc-CTHCC表达 , 进而抑制或促进肝癌细胞的恶行生物学行为 。 因此 , METTL3通过增加对lnc-CTHCC的m6A修饰 , 上调lnc-CTHCC的表达 , 发挥对肝癌细胞的调节功能 。
文章图片
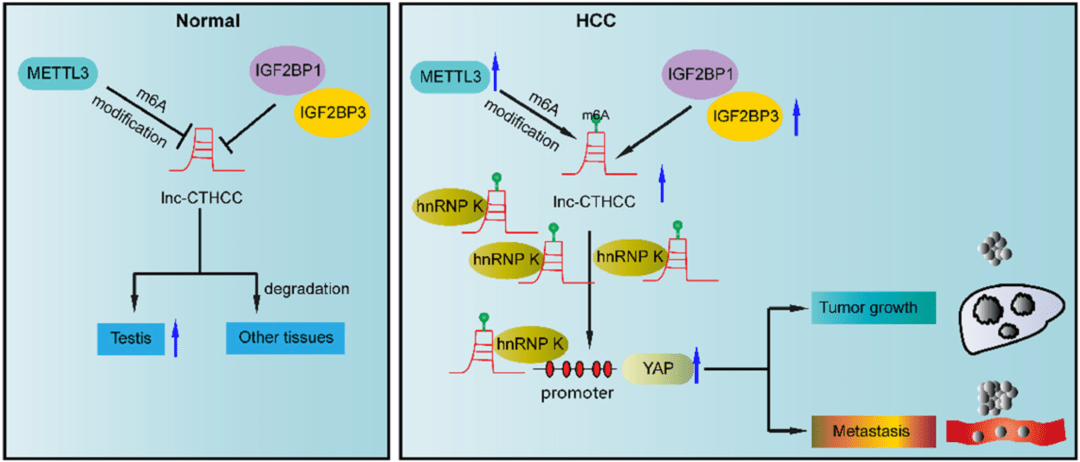
▲ 本文机制示意图(Normal:正常组织;HCC:肝癌组织)
本研究中 , 研究人员先是通过生信分析 , 发掘和鉴定了一个新的CT基因 , lnc-CTHCC;尔后 , 通过一系列的实验 , 探索和验证了lnc-CTHCC在METTL3–IGF2BP1/IGF2BP3–lnc-CTHCC–hnRNP K–YAP1轴中发挥的关键作用 。 整个过程丝丝入扣 ,创新性地提出CT-lncRNA是驱动肝癌发生的新靶标 , 有望为肝癌的个性化治疗提供新思路 。
- 杨女士|癌症治与不治都是死,不如花钱游山玩水肿瘤科主任说出了大实话
- 胰腺癌|癌症来临时,身体会“喊痛”!身上若出现5种痛,千万别大意了
- 从容|《2022安盛心理健康状况调研报告》:新冠疫情挑战为心理健康发展带来契机,健康意识和韧性均显著提升
- 绿茶|我们怕癌,但是癌更害怕它们,尽量多吃这3种食物,让癌症远离你
- 研究人员|喝茶不养生,还可能“养癌”?50万国人研究:喝茶与多种癌症有关
- 倾向|家族当中有几个近亲得了癌症,我们应该怎么做?
- 饮食|想要预防癌症,要在饮食上做出一定改变,提醒:3样食物尽量少吃
- 因素|焦虑男易患两大疾病
- 有“癌症抗体”的人,可能有这6个“共性”,你有吗?
- 癌症|孩子出现关节痛、瘀斑等症状,家长需警惕这种疾病
