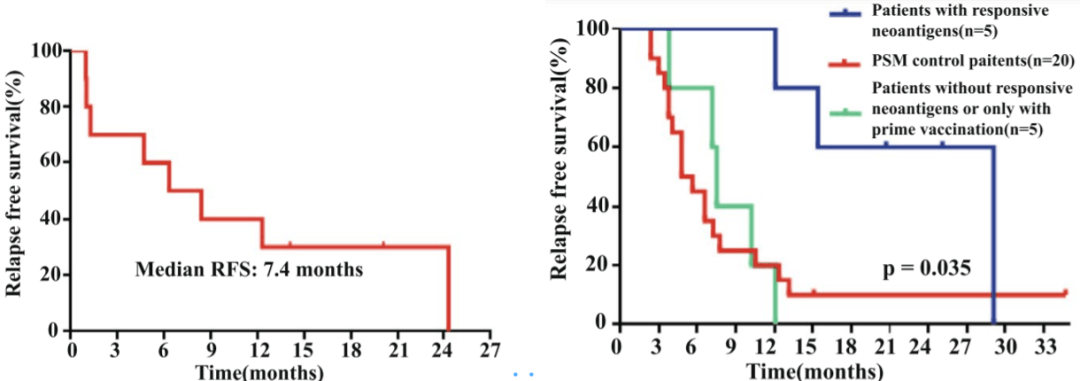
进一步分析发现 ,与对照组、只接种了启动阶段的疫苗或者对抗原疫苗没有反应的患者相比 , 接种完全新抗原后且产生免疫反应的患者RFS显著增加(中位RFS: 4.8个月vs 6.7个月vs 19.3个月 , P=0.035) 。
文章图片
▲ HCC患者接种后无复发生存期的Kaplan-Meier生存曲线
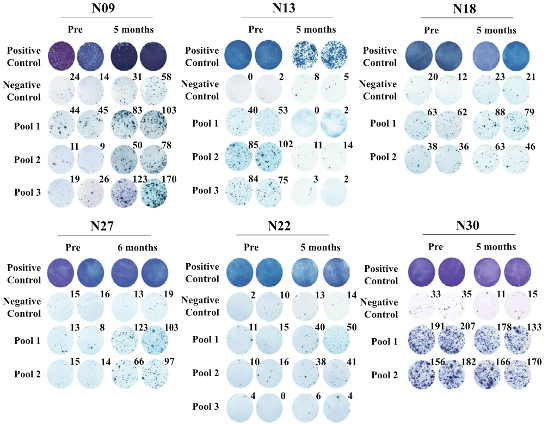
接着 , 研究团队对7位患者完全接种后的免疫反应进行了监测分析 , 大致可以分为以下四类:
- 接种前后都未产生新抗原特异性免疫应答 , 如N06患者 。
- 接种前后的免疫反应强度相似 , 如患者N30 , 这可能是新抗原疫苗、预防性TACE或该患者免疫系统对新抗原敏感综合或单一因素导致的结果 。
- 接种前就产生了针对新抗原肽的特异性反应 , 如N13、N18和N30三位患者 , 可能是预防性TACE治疗释放的肿瘤新抗原激活了特定的T细胞; 但是在疫苗接种期间 , N13患者的新抗原免疫反应迅速衰减 , 并且在加强疫苗接种后已经检测不到 , 这说明新抗原疫苗未能成功诱导激活N13患者体内的T细胞反应 , 而N18患者接种完成后的新抗原特异性反应比疫苗接种前强得多 。
- 接种后产生了强大的、新抗原特异性免疫反应 , 如N09、N22和N27三位患者 。
文章图片
▲ 6位患者在新抗原疫苗接种前后的体外IFN-γ ELISpot反应结果
从上述结果来看 , 接种新抗原疫苗能够有效诱导激活HCC伴血管浸润患者体内的特异性免疫应答 , 且相应地延长患者的无复发生存期 ,证实了个性化新抗原疫苗用于预防肝癌患者术后复发的安全性和可行性 。
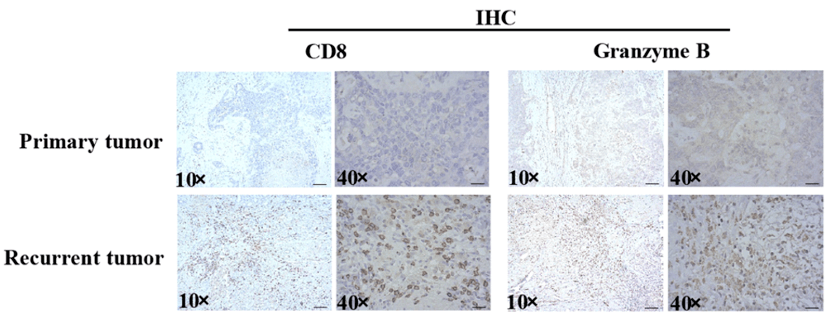
随后 , 研究者们收集了N22患者复发的肿瘤组织 , 对新抗原疫苗接种后的免疫微环境动力学进行了严格评估 , 他们发现 ,新抗原疫苗治疗后 , 复发肿瘤中的免疫炎性反应整体上调 , 如CD8+T细胞、颗粒酶比例增加 。
文章图片
▲ 原发肿瘤与复发肿瘤中CD8+ T细胞和颗粒酶B的免疫组化染色
但肿瘤组织超级强大的适应性或将成为未来癌症治疗另一大难点 , 刘小龙团队发现 ,复发肿瘤组织中携带这些新抗原的细胞比例显著下降 , 而且这些肿瘤还有自我进化的能力 , 能产生新的突变去逃避新抗原疫苗激活的免疫反应 。
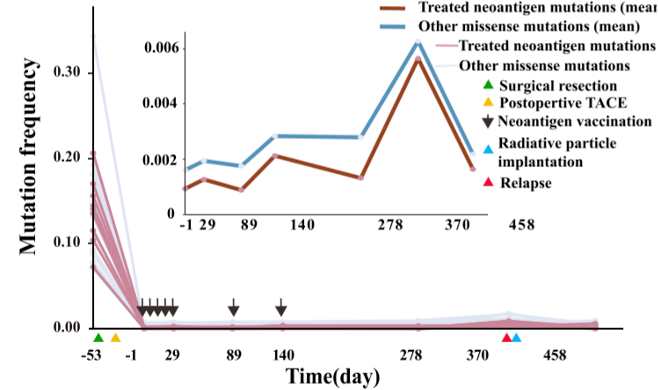
故此 , 实时监测免疫和临床反应对于评估新抗原疫苗接种后的反应性、预测其功效则显得至关重要 。 研究工作继续深入 , 他们 通过追踪患者血液里ctDNA中的个性化新抗原突变 , 成功实现了对HCC患者免疫和临床反应的实时监测和评估 。
文章图片
▲ N09患者治疗后新抗原突变和其他体细胞突变定量水平的时间-过程曲线
总的来说 , 这个研究证实了基于个性化新抗原疫苗可作为一种安全高效的抗术后肝癌复发策略 , 而且追踪ctDNA中个体化新抗原突变的技术有助于个体化医学在临床上的实际应用 。
然而 , 由于时间、资金及样本量有限 , 相应的研究发现仍需要在大规模临床试验中进行严格验证和评估 。 另外 , 如上所说的肿瘤适应性也是今后需要克服的重大项目之一 。
参考文献:
1.Sahin U, Türeci ?. Personalized vaccines for cancer immunotherapy. Science. 2018;359(6382):1355-1360. doi:10.1126/science.aar7112
3.Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66(2):115-132. doi:10.3322/caac.21338
- 肝胆疾病|女性晚上当零食吃几颗,美肤淡斑,大肚子也平了,越来越年轻
- 北京冬奥运动|国际奥委会:北京冬奥运动员村相关人员新冠疫苗接种率接近100%
- 接种|北京市累计报告接种新冠病毒疫苗5797.48万剂次
- 国家|全国累计报告接种新冠病毒疫苗293763.2万剂次
- 接种|北京累计接种新冠病毒疫苗2255.82万人
- 接种|?哈尔滨市疾病预防控制中心发布疫情防控提醒
- 宝山接种“加强针”随到随打!这些地方可接种
- 【1月17日-1月23日】市本级新冠疫苗接种点信息→
- 够狠!该省宣布不打疫苗就交税后,预约接种人数激增
- 不要盲目等待!专家提醒:HPV疫苗应尽早接种
