文章图片
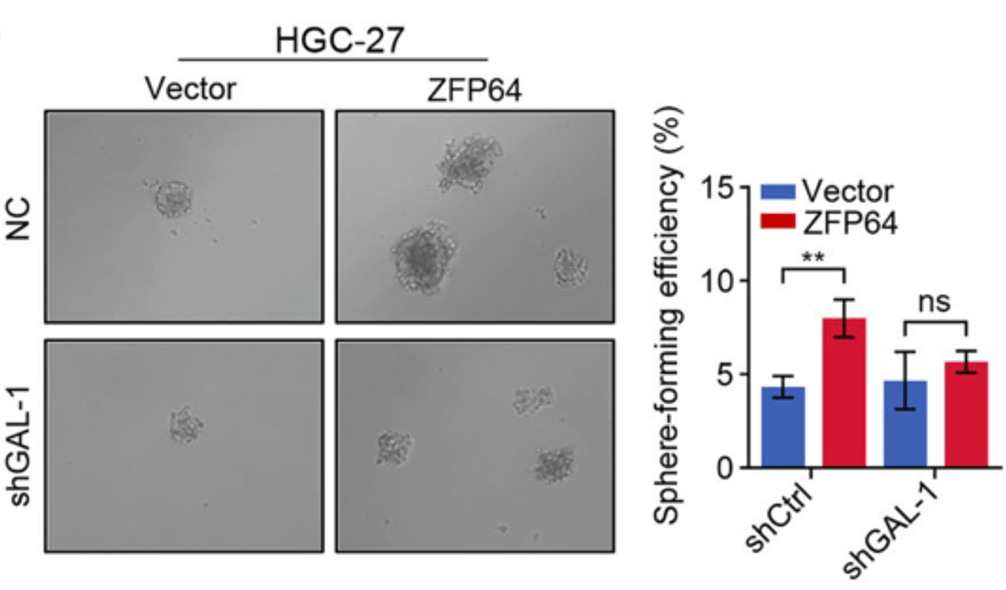
▲ 敲低GAL-1能够抑制ZFP64诱导的肿瘤干细胞形成
这让研究人员十分激动 , 为了确认GAL-1与ZFP64之间存在联系 , 基于已有研究报道GAL-1能够激活MAPK以及PI3K-AKT信号通路 , 研究人员利用胃癌细胞系首先证明ZFP64能够激活GAL-1下游的信号分子 , 如ERK的磷酸化、AKT的磷酸化等 , 但与p65无关 。
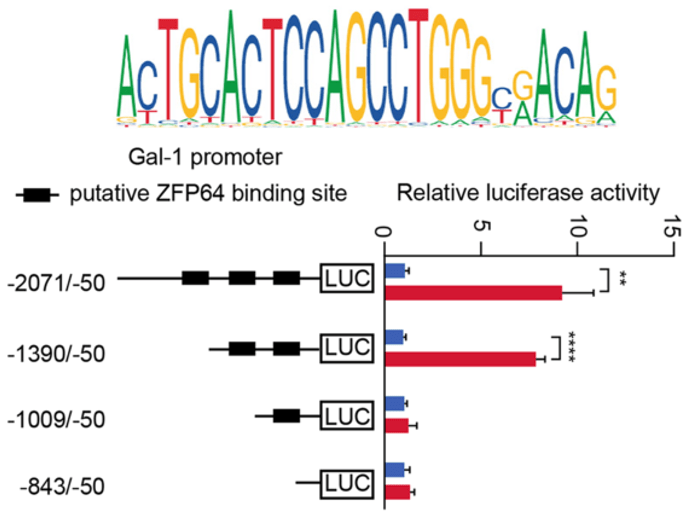
并且 , 通过双荧光素酶报告基因检测也证明 ,ZFP64能够结合并激活GAL-1启动子区域 , 从而促进其转录 。
文章图片
▲ 作为转录因子的ZFP64的核心激活区域
到这里 , “ZFP64/GAL-1能够促进肿瘤细胞抵抗nab-紫杉醇”的猜测已被证明 。
【通路|JECCR:复旦中山医院团队破解胃癌对nab-紫杉醇耐药之谜】考虑到ZFP64和GAL-1也均参与免疫反应 , 研究人员又进一步猜测ZFP64/GAL-1是否还可以通过调控肿瘤免疫微环境来影响胃癌患者的预后 。
于是 , 研究人员收集了来自人源化NSG小鼠模型的肿瘤组织 , 并分析了其中CD45+肿瘤浸润白细胞的免疫细胞组成 。 他们发现: ZFP64表达量高的肿瘤组织中CD8+ T细胞显著少于ZFP64表达水平较低的肿瘤 。 并且 , 体外实验进一步证明:ZFP64高表达的肿瘤细胞 , 会诱导共培养的CD8+ T细胞发生凋亡 , 而GAL-1干扰则会抑制这一过程 。
也就是说: ZFP64/GAL-1会促进肿瘤免疫抑制微环境的形成 。
▲ ZFP64/GAL-1对免疫微环境的影响
基础问题来源于临床 , 最后也要回归于临床 。 因此 , 在找到了胃癌患者对nab-紫杉醇耐药且预后差的问题后 , 是否可以通过联合治疗来促进nab-紫杉醇的治疗效果呢?
于是研究人员在体外分别尝试了多个抑制剂 (MK2206—AKT抑制剂 , U0126—ERK1/2 抑制剂 , OTX008—GAL-1抑制剂)与nab-紫杉醇的联用 , 最后发现 OTX008与nab-紫杉醇联用抗癌效果最显著!
▲ 联合治疗效果
总而言之 , 转录因子ZFP64激活GAL-1及其下游信号通路 , 促进肿瘤干细胞的形成 , 进而增强肿瘤细胞的耐药能力以及转移能力 , 同时促进肿瘤细胞免疫抑制微环境的形成 , 使得胃癌患者的生存期大大降低 。
因此 , 靶向ZGP64/GAL-1的药物研发为nab-紫杉醇治疗不敏感型胃癌患者提供了一种极具有前景的治疗方案 , 同时也能够对局部晚期或转移性胃癌患者提供帮助 。

文章图片
参考文献:
[6] Mack HG, Beck F, Bowtell DD. A search for a mammalian homologue of the Drosophila photoreceptor development gene glass yields Zfp64, a zinc finger encoding gene which maps to the distal end of mouse chromosome 2. Gene. 1997;185(1):11-17. doi:10.1016/s0378-1119(96)00607-5
[8] Cedeno-Laurent F, Dimitroff CJ. Galectin-1 research in T cell immunity: past, present and future. Clin Immunol. 2012;142(2):107-116. doi:10.1016/j.clim.2011.09.011
- 家长|复旦儿科MDT团队巧取胃内巨大结石 4岁女童转危为安
- 樊嘉|复旦大学附属中山医院落子大丰,项目总投资10亿元
- 复旦大学|“平移技术和理念 实行同质化管理”盐城大丰与复旦大学附属中山医院合作共建苏北健康管理中心
- 复旦|广东省人民医院新急诊科启用,含急诊ICU床位14张
- 复旦大学|复旦大学附属中山医院心内科教师团队获评第二批全国高校黄大年式教师团队
- 团队|“第二批全国高校黄大年式教师团队”出炉 复旦大学附属中山医院心内科教师团队入选
- 上海复旦|活到112岁的名媛,不爱锻炼,喜欢吃肉,养生秘诀只有十个字!
- dn32岁复旦女博士患癌,8次化疗离世,她死前的一个反思,令人警醒
- 小义|20分钟让17岁少年“重生”!复旦儿科完成华东首例儿童经右心室肺动脉支架瓣膜植入术
- 大脑背腹侧语言通路中断可引发严重失语
