免疫检查点抑制剂(ICB)一直都备受医学界的追捧 。 在2018年 , 诺贝尔生理学或医学奖更是被颁给了两位免疫学家 , 以表彰他们“发现负性免疫调节治疗癌症的疗法方面的贡献” [1] 。 可是 ,临床上免疫检查点抑制剂在结直肠癌患者中的治疗有效率仅为15% 。
【肿瘤|《科学》子刊:中国医学科学院团队破解肠癌“排斥”T细胞之谜】造成这种疗效异质性的现象在一定程度上归结于免疫细胞的浸润程度不同 , 尤其是CD8+T细胞的浸润 。 CD8+T细胞在结直肠肿瘤中的高度浸润 (“热肿瘤”)不仅能够提示良好的预后 , 还能预示患者对免疫治疗的有效性 。 而 大部分患者都呈现出“冷肿瘤”的状态 , 也就是在肿瘤中只存在少量浸润的CD8+T细胞 , 因而降低了ICB对结直肠癌的治疗疗效 。
所以 , 如何把“冷肿瘤”改造成“热肿瘤”也就成为了大家研究的焦点!
为了解决这一问题 , 近日 ,中国医学科学院药物研究所的花芳教授和中国医学科学院肿瘤医院的张海增主任共同领导的课题组 , 在 Science Translational Medicine发表了重要的研究成果[2] 。
研究发现 , 结直肠癌中的一种促癌蛋白TRIB3会抑制STAT1-CXCL10信号通路 , 进而减少CD8+T细胞的浸润 。 如果用药物靶向降低TRIB3蛋白的稳定性 , 可以逆转这一现象 , 从而增强免疫检查点抑制剂的疗效 。

文章图片
论文首页截图
现在我们就一起来看看这个研究是如何开展的 。
前期研究已经证明 促癌蛋白TRIB3能够促进结直肠癌的干性和肿瘤进展 。 越来越多的研究也发现TRIB3具有免疫调节的功能 。 为了进一步探索TRIB3在结直肠癌中潜在的免疫调节作用 , 本研究聚焦于TRIB3对CD8+T浸润产生的影响 。
首先 , 研究人员将对照和敲低Trib3基因(Trib3 KD )的小鼠结直肠癌MC38细胞系分别皮下种植于免疫正常鼠和免疫缺陷鼠 。 结果发现 , 相比于对照组 ,Trib3 KD 细胞在两种小鼠中都显示出肿瘤负荷降低的现象。
值得注意的是 , 在不同老鼠模型中肿瘤负荷降低的程度却显著不同:即相较于对照组而言 ,Trib3 KD 组在免疫正常小鼠中的肿瘤负荷下降了80% , 而在免疫缺陷鼠中只有50%。 由此 , 他们推断TRIB3可以介导抗肿瘤的免疫调节功能 。 进一步的实验也证实了这一猜想 , 相较对照组而言 ,移植Trib3 KD MC38细胞的小鼠瘤内功能性CD8+T细胞的浸润增加。
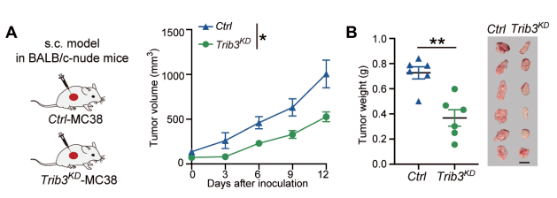
文章图片
Trib3 KD 细胞在免疫正常小鼠中肿瘤负荷下降80% , 而在免疫缺陷鼠中只有50%
肥胖可以诱导TRIB3表达[3] 。 通过比较肥胖结直肠癌和非肥胖结直肠癌患者的肿瘤组织样本 , 他们观察到了和小鼠模型一样的现象 , 即高表达TRIB3的肥胖结直肠患者样本中显示出更少浸润的CD8+T细胞 。
为了进一步验证 , 他们采用了肥胖小鼠模型 。 结果和患者样本一致 , 与非肥胖的小鼠相比 , 肥胖小鼠呈现出高表达TRIB3、肿瘤高增殖、而少杀伤性的CD8+T浸润的特点 。 另外 , 在肥胖小鼠模型中皮下种植Trib3 wt MC38和Trib3 KD MC38细胞 ,Trib3 KD MC38组中的肿瘤几乎不生长。
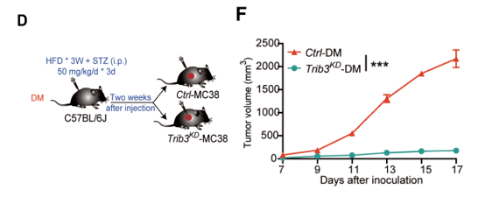
文章图片
在肥胖小鼠模型中 , Trib3 KD 肿瘤几乎不进展
到这里 , 该团队已经确定了 TRIB3可以通过调节CD8+T细胞的浸润 , 来达到影响结直肠癌的形成和生长的目的 。
接下来 , 他们进一步去分析了TRIB3调控结直肠癌的机制 。
- 大年|多嚼就能少胖!科学家发现咀嚼会增加进食消耗的热量,积少成多不容易胖丨奇点过大年
- 春季多吃葱蒜顺养肝气抗肿瘤
- 手术|安分了十几年的肿瘤突然变大十多倍,到医院一检查,个头比甜瓜还要大
- 饮食|老年人身体素质的提高,科学饮食是关键
- 春季要学会科学饮水
- 冬藏|中医说的“冬藏”,究竟怎么“藏”?
- 食物|春节期间,如何科学选择零食
- 早春全方位调整
- 肿瘤|致敬!院士放弃专利让救命药一盒仅290元
- 春季饮食红枣的妙用之处
